トップ > 患者さん・一般の皆さま > 輸液と栄養 > 輸液の単位


輸液の単位
(監修) 日本医科大学腎臓内科名誉教授 飯野靖彦先生

Na+やCl-などの電解質組成は、mEq/Lで表されます。糖質やアミノ酸はg /L(1000mLに溶けている物質のg数)で表示されます。これは、糖質やアミノ酸はイオンとして働くものではないからです。
例えば、電解質である食塩(NaCl)は、水に溶かすとイオンに分かれます。
NaCl → Na+ + Cl-
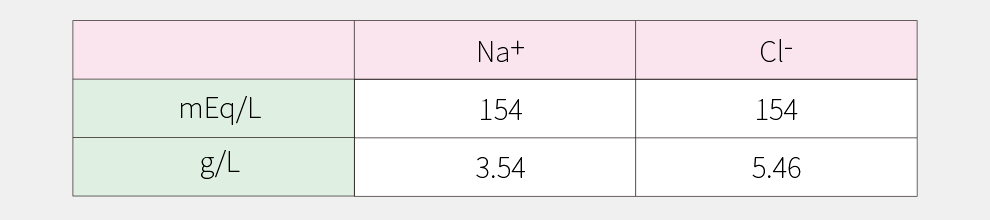
Na+は1価の陽イオン、Cl-は1価の陰イオンです。生理食塩液を例に電解質組成をみた場合、g/LではNa+が3.54g/L、Cl-が5.46g/Lで、陽イオンと陰イオンのバランスがとれているかどうかわかりません。このため、電解質はmEq/Lで表します。
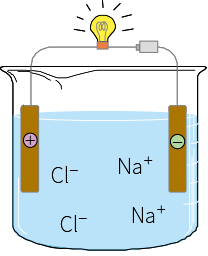
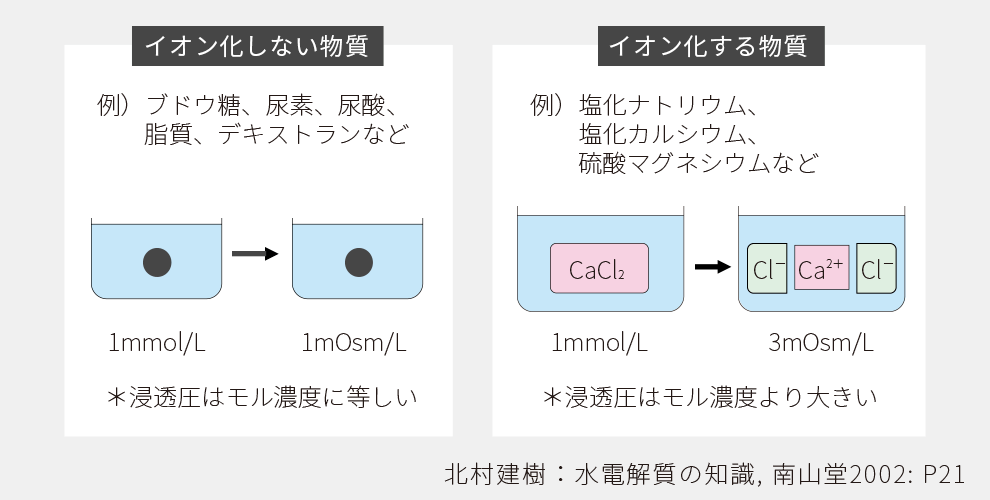
体液の中に含まれる成分には、電解質と非電解質があります。電解質は、水に溶かすとイオン化するもので、+電極に引き寄せられるものが陰イオン、 −電極に引き寄せられるものが陽イオンです。陽イオンはNa+、K+、Ca2+、Mg2+などで、陰イオンにはCl-、HCO3−、HPO42-、SO42-、有機酸、タンパク質などがあります。イオンの種類によって電荷の数が異なり、1価のイオンはNa+、K+、Cl-、HCO3−など、2価のイオンはCa2+、Mg2+、HPO42-、SO42-などがあります。非電解質は、水に溶かしても解離しない(イオンにならない)もので、血液中に含まれるブドウ糖、脂肪、尿素などがあります。
%:溶液100mL中に溶けている溶質のグラム(g)数
%は、溶液100mLに溶けている物質の重量(g)で、糖質やアミノ酸の濃度もこの%で表されます。
参考
mol/L:溶液1L中に溶けている溶質のモル(mol)数

mol/Lは、溶液1Lに溶けている物質のモル(mol)数を表します。1モルの重さは、その物質の原子量または分子量のグラム数を表します。つまり、Na 1モルの重さは、Naの原子量グラムであり23gとなります。
NaCl(58.5g)→Na+(23.0g)+Cl-(35.5g)
例えば、生理食塩液は1L中に9gの食塩が溶解しているので、
9/58.5=0.154mol/L(M)
輸液では通常この1/1000の単位のmmol/L(mM)が用いられます。
mEq/L : 溶液1L中に溶けている溶質の当量数
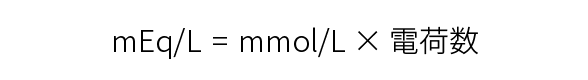
mEq/Lは、電解質の濃度を表す単位で、溶液1Lに溶けている物質の当量数です。体液や輸液に含まれる電解質量を表します。Eqはequivalent(イクイバレント)の略、mEq(ミリイクイバレント)はEqの1/1000の単位です。イオンの電荷は、イオンの種類により異なりますが、各イオンは同じ電荷数(当量)で反応します。
例
生理食塩水は154mmol/L NaClを含みますが、Na+、Cl-はそれぞれ何mEq/L?
Na+、Cl-はそれぞれ電荷数が1なので、154mmol/L ×1=154mEq/L となります。
1mmol/L塩化カルシウム(CaCl2)は、Ca2+、Cl- それぞれ何mEq/L?
CaCl2→Ca2++2Cl-
1mmol/L1mmol/L2mmol/L
Ca2+では mmol/L × 電荷数=1mmol/L × 2=2mEq/L
Cl-ではmmol/L × 電荷数=2mmol/L × 1=2mEq/L
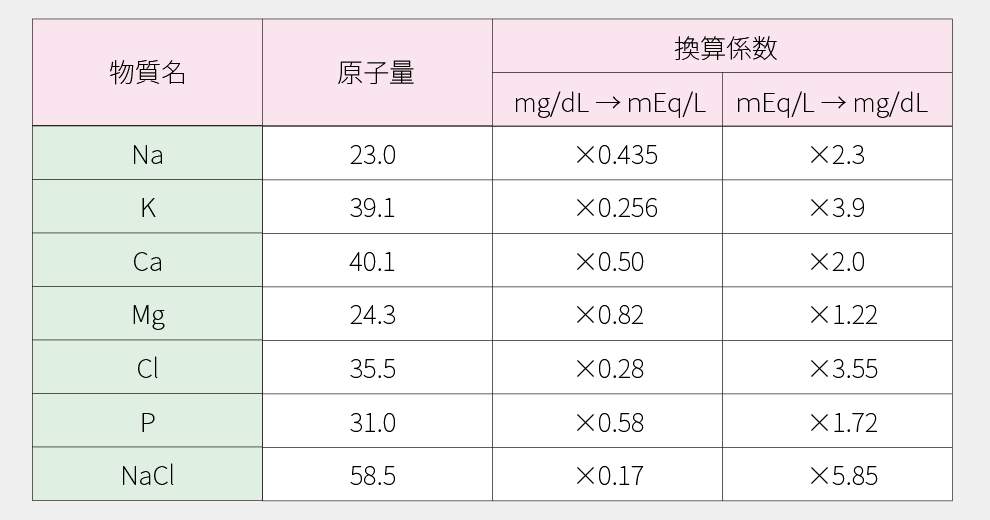
重量を濃度に、また、濃度を重量に変換する場合の換算係数を示します。
mOsm/L : 溶液1L中に溶けている粒子の数
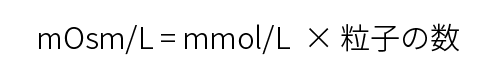
mOsm/Lは浸透圧を表す単位で、溶液1L中に溶けている粒子数です。浸透圧は、各イオン粒子のモル数の総和で求められます。浸透圧は、浸透圧計を用いて測定されます。その時の単位はmOsm/kgH2Oで表しますが、生理的な濃度範囲では両者の差は少なく、通常はmOsm/Lが用いられます。イオン化する物質とイオン化しない物質では浸透圧の計算方法が異なります。
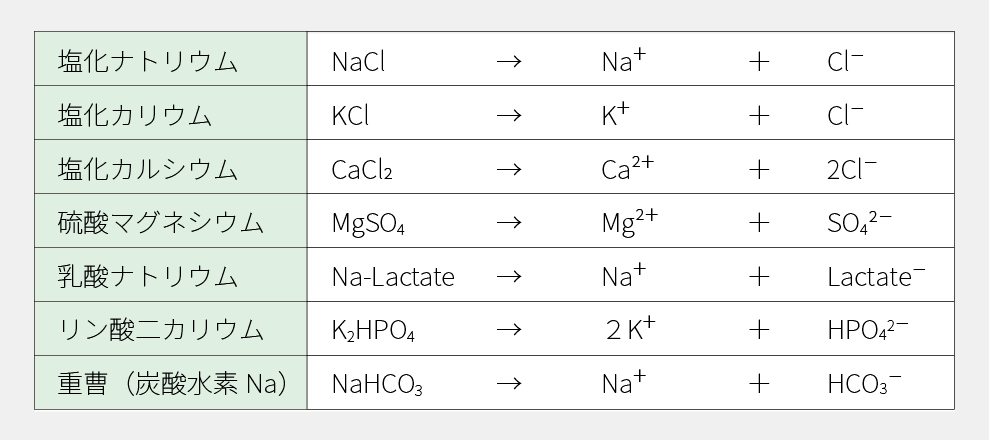
輸液に含まれる、主な電解質の解離式を示します。

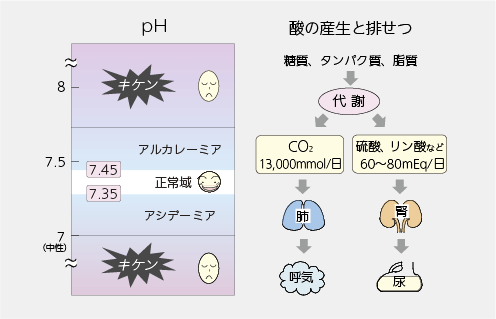
pHは溶液が酸性かアルカリ性であるかの指標です。血液のpHは7.4で、中性(pH7.0)よりもややアルカリ性に傾いています。私たちのからだは、代謝により常に酸を産生しています。エネルギー代謝によって産生されたCO2(炭酸ガス)は肺から呼気中に、また主にタンパク代謝に由来する硫酸やリン酸は腎臓から尿中に排せつされ、正常状態では、常に7.35~7.45の狭い範囲に調節されています。単にpHの値を見て7.35より低下すればアシデーミア(酸血症)、7.45より上昇すればアルカレーミア(アルカリ血症)といいます。何らかの異常によって、血液のpHが正常域から酸性側に傾く病態をアシドーシス、アルカリ側に傾く病態をアルカローシスといいます。